受疫情的影响,美国对于防护用品的需求是非常大的,中国企业如果想把这些产品出口到美国并非易事,除了商务部的白名单,还需要美国的FDA注册。那么,防护服、隔离衣、手术服等防护用品出口美国FDA认证办理流程是什么样的呢?我们一起来看下。
1、FDA要求所有在美国上市的医疗器械产品都需要进行:
设施注册/公司注册(Establishment, Owner/Operator Registration)
产品注册/产品列名(MDL: Medical Device Listing)
指定FDA注册的美国代理人US Agent
涉及到FDA510(K)或PMA监管的产品,还需要先申请510(K)或PMA获批后,才可以进行产品注册
防护服、隔离衣、手术服等防护用品出口美国需要做FDA510K申报。那么,隔离衣、外科口罩、防护服、手术服的FDA510K的办理流程和周期是怎么样的?
2、防护服、隔离衣、手术服、外科口罩、丁腈手套等产品FDA的办理流程:
申请人递交510K文件
申报受理
FDA一阶段审核
递交发补资料
FDA二阶段审核
通过评审,取得K号

3、隔离衣、外科口罩、防护服、手术服的FDA的办理周期
按照2类医疗器械的控制方式,递交510K文件至FDA进行评审,取得K号后列名注册。这一系列的过程至少需要6个月的时间。
4、防护服、隔离衣、手术服做FDA需要做哪些检测?
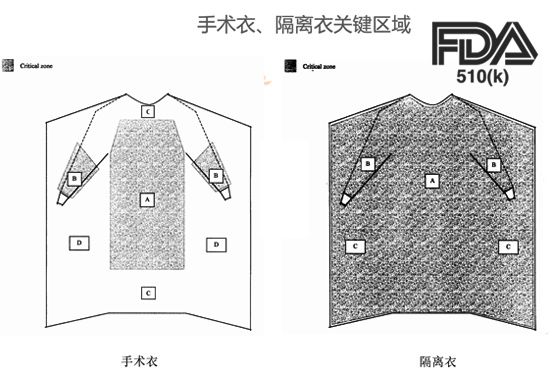
以手术衣为例,前方完整区域(A,B,C)要求至少达到Level 1的水平。
手术衣关键区域至少包含A和B区域(一般检测时都按照3个关键部位进行测试,即:chest, sleeve seam, tie 胸部,袖缝,绑带)。
手术衣可以不防护背部。
2.1性能部分
AAMI/ANSI PB70:2012 AAMI/ANSI PB70:2012
(可将产品分为LEVEL 1, LEVEL 2, LEVEL 3, LEVEL4, Level越高,防护等级越高,所做的检测项目不同,费用也不同。);
CPSC 16 CFR Part 1610;
ASTM D5034 (拉力强度);
ASTM D5587(纺布织物撕裂强度)/ D5733 (无纺布织物撕裂强度);
ASTM D1683 (纺布材料和非纺布材料的缝合强度);
2.2生物学部分
ISO10993-5
ISO10993-10
ISO 10993-7 (如为环氧乙烷灭菌)
以上就是关于“隔离衣、防护服、手术服等防护用品出口美国FDA注册办理流程详解!”的相关内容,我们可以为企业提供FDA510K的申报服务,服务内容包括:
1) 依据企业提供产品信息确定产品的代码及分类
2) 根据确定的产品代码寻找对应的注册指南或相关文件,协助企业寻找比对器械,确定产品需要准备的资料和检测项目(拥有独立SUNGO实验室,或者厂家自己找第三方实验室协调)
3) 在企业准备资料和检测的过程中提供法规技术支持
4) 依据企业提供的相关资料编制510K报告
5) 指导企业向FDA递交小企业资质申请
6) 美国设有专职FDA服务型公司作为企业的美国代理人。协助企业向FDA申请付款编码,指导企业安排美金支付
7) 递交510K报告至FDA进行评审,负责与FDA联络沟通,并指导协助企业进行整改,直至项目评审结束
8)有专业QSR820辅导(FDA验厂辅导)团队,后期企业若有验厂需要,可为企业提供验厂辅导服务
FDA抽查工作准备
FDA明文规定,手术衣不豁免21CFR Part 820,即QSR820体系。获得FDA510K注册的企业,日常过程中品质记录、生产记录、销售记录很重要。
- FDA注册
- 暂无标签