
鉴于欧盟医疗器械市场的重要性,国内医疗器械制造商对于即将到来的欧盟医疗器械法规(MDR)都非常关注,都在积极准备以满足新法规的要求。那么欧洲进口商是如何看待即将到来的MDR法规的呢? Part1 来自欧洲进口商的要求 进口商对于制造商的要求有五个方面: ■ 制造商需要按照MDR签署欧盟授权代表协议 ■ 对于每个产品需...
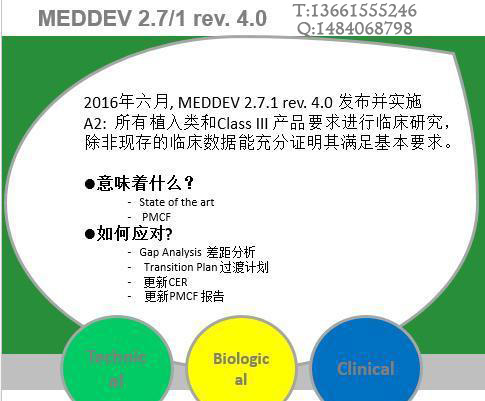
致各医疗医疗制造商: 欧盟医疗器械临床评价指南于进行了第四次修订, 目前大多数的公告机构已经不再接受基于第三版指导原则的临床评价报告;之前按照第三版完成临床评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价。 MEDDEV 2.7.1第四版的大变化之一,就是证明“实质等同”的难度要比之前大很多。关...

• 什么是临床评估报告? • 谁需要提交临床评估报告? • MEDDEV 2.7.1(第4版)是如何定义临床数据的? 临床评估报告(CER) 制造商如果打算在欧洲销售医疗设备,必须提供一个符合MEDDEV 2.7.1(第4版)和MDD或MDR 2017/745的临床评估报告(Clinical Evaluation ...
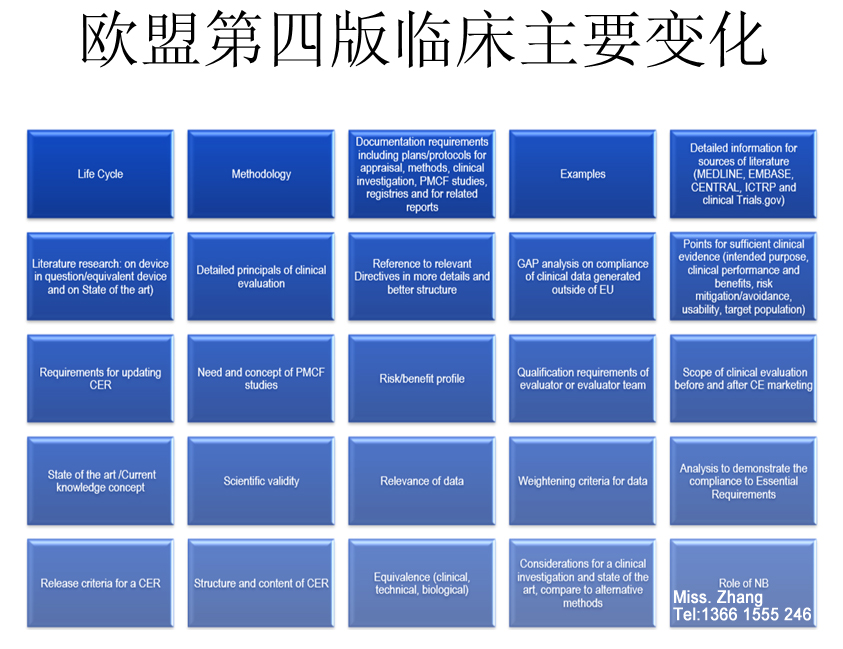
CE第四版临床评价报告MEDDEV 2.7/1 Rev. 4编写,你想知道的都在这了! 欧盟医疗器械临床评价指南于进行了第四次修订, 目前大多数的公告机构已经不再接受基于第三版指导原则的临床评价报告;之前按照第三版完成临床评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价。 MEDDEV 2.7.1...