
一、MDR简介2017年5月5日,欧盟官方公报正式颁布了“欧盟医疗器械法规”(REGULATION(EU)2017/745,简称“MDR”)。 MDR将取代指令90/385/EEC(有源植入式医疗器械指令)和93/42/EEC(医疗器械指令)。根据MDR第123条的要求,MDR于2017年5月26日生效,并于2020年...
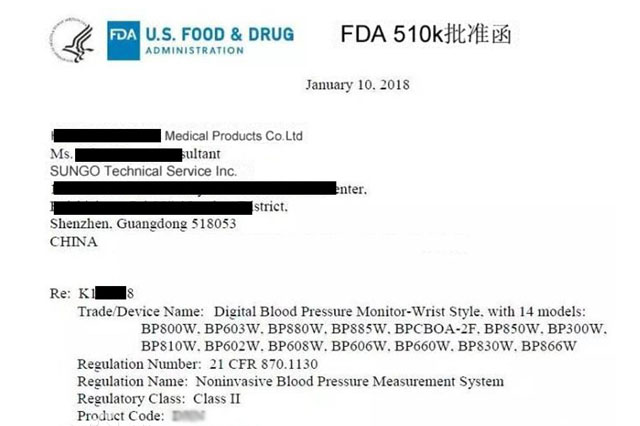
FDA510(k)即上市前通告,在美国上市医疗器械,若其产品是不需要上市前批准申请(PMA)的I、II和III类设备,则其必须向FDA递交510(k),除非该设备依据联邦食品、药品和化妆品法案(FD&C法案)豁免510(k)要求。在产品上市前,每个510(k)递交者必须收到FDA发出的信件格式指令,指明该设备是...


一、FDA工厂检查背景简介1)FDA及其驻华办公室简介全称:U.S. Food and Drug Administration美国食品药品监督管理局,隶属于U.S.Department of Health and Human Services (HHS)美国卫生与人类服务部职能:FDA为美国食品药品监督管理局,隶属于H...



前言: 12月25日,国家药监局器审中心组办的“人工智能类医疗器械注册申报公益培训”在北京进行。本次培训详细讲解了人工智能医疗器械的审评关注点,并且结合实例进行分析,为企业答疑解惑,值得点赞!本文将按照以下顺序展现给大家: 医疗器械软件分类 医疗器械软件法规综述 医疗器械软件注册审评关注点 人工智能医疗器械软件上市前景...

医疗用品才可以办理欧盟自由销售证书的,欧盟国家有CE证书,ISO 13485证书就可以了,中东,南美 尤其是:沙特、阿根廷、埃及 这些国家会要这种欧盟自由销售证书的,客户销售企业的产品的时候,当地政府要求必须注册成功才可以销售产品,那么注册的时候是需要这些文件的,MHRA颁发的自由销售证书,能证明企业生产的产品满足欧盟...
据澳大利亚医疗用品法(Therapeutic Goods Act 1989)规定,所有在澳大利亚上市的医疗用品(药品和医疗器械)必须按有关要求,向澳大利亚医疗用品管理局(Therapeutic Goods Administration, TGA)提出注册或登记申请,获得注册登记(Australian Register...

美国FDA主管:医疗器械、食品、药品(包括兽药)、食品添加剂、化妆品、动物食品及药品、酒精含量低于7%的葡萄酒饮料以及电子产品的监督检验;产品在使用或消费过程中产生的离子、非离子辐射影响人类健康和安全项目的测试、检验和出证。根据规定,上述产品必须经过FDA检验证明安全后,方可在市场上销售。FDA有权对生产厂家进行视察...

出口美国眼镜类产品、太阳镜产品都需要办理FDA注册,眼镜(除隐形眼镜外)和太阳镜均属于医疗器械I类FDA注册产品范围,另外,清关时还需要提供眼镜片FDA滴珠证明(FDA 21 CFR 801.410 Impact Test),因此,眼镜出口美国需要具备FDA注册和FDA滴球测试证明方可顺利清关销往美国市场 医疗器械F...

二三类生产无菌医疗器械洁净区的要求和选择 在二三类的医疗器械生产过程中,人员、工装模具、机器设备、原辅材料、外购(外协)件、内包装材料加工工艺、生产环境等直接影响产品的质量。对于生产无菌医疗器械来说,它们都有可能对产品造成污染和微生物超标等,对于不同的无菌医疗器械应用范围,我们需要在不同的洁净区生产,方可达到国家相关法...

1. Medical Devices FDA510(K)文件也即FDA对PMN所需的文件,因其相应FD&C Act第510章节,故通常称510(K)文件。对510(K)文件所必须包含的信息,FDA有一个基本的要求,其内容大致如下16个方面: 1) 申请函,此部分应包括申请人(或联系人)和企业的基本信息、5...

什么是欧盟授权代表? 欧盟授权代表(European Authorised Representative 或European Authorized Representative)是指由位于欧洲经济区EEA(包括EU与EFTA)境外的制造商明确指定的一个自然人或法人。该自然人或法人可代表EEA境外的制造商履行欧盟相关的指...

越来越多的中国医疗器械企业把产品出口到全球各地,很多进口国强制要求生产商提供 “自由销售证书(FSC)” 他们并不认可中国药监局出具的相关证书,只认可欧盟国家官方机构出具的 “自由销售证书(FSC)”。1. 什么是自由销售证书?自由销售证书Free SalesCertificates,简称FSC。通常用于医疗产品的出口...