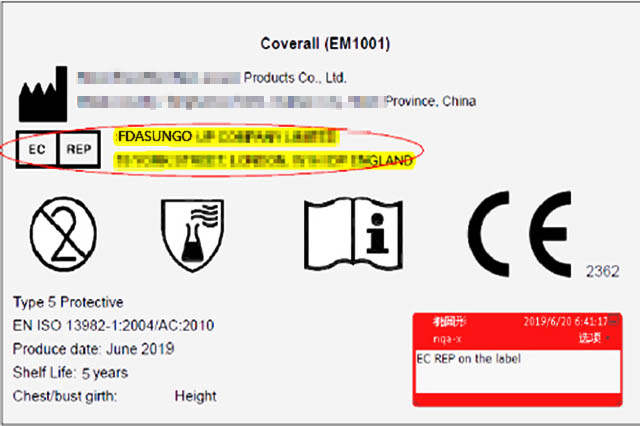
1.欧代的必要性 1.1背景知识 为了更好地保护欧盟的消费者和环境,为了实现产品的可追溯性 (Traceability),欧盟的法律要求,如果制造商来自欧洲经济区EEA(包括EU与EFTA)以外的国家,其产品必须同时标有制造商和欧盟授权代表的名称和联络地址。 1.2欧代要求 欧盟授权代表(Euro...

2017年5月,欧盟医疗器械新法规MDR (REGULATION EU 2017/745) 颁布,新的法规将替代原有的医疗器械指令(MDD 93/42/EEC) 和有源植入性医疗器械指令(AIMDD 90/385/EEC) 。 从2020年5月开始公告机构不能按照MDD颁发CE证书,目前I*及以上风险等级产品认证机构已...

什么是FDA?FDA是食品药品监督管理局(Food and Drug Administration)的简称。食品药品监督管理局(FDA)主管:食品、药品(包括兽药)、医疗器械、食品添加剂、化妆品、动物食品及药品、酒精含量低于7%的葡萄酒饮料以及电子产品的监督检验。 如何申请FDA认证呢?企业如果申请FDA 首先要有一个...

办理一个欧盟自由销售证书多少钱和申请证书的产品有关,也和选择办理的欧盟国家机构有关。例如:英国、荷兰、德国,收取的费用不同。另外出口目的国数量不同也有差异。 欧盟自由销售证书是指在非欧盟国家进行注册和再注册需要的,或者是随着设备运输的一份证明文件。英文全称 free sales certificate,简称CFS/FS...

最近有了解到,有的企业认为CE认证内容更新了,有的觉得说的应该是MDR新医疗器械法规。下面跟大家解释下: 2017年5月5日,欧盟官方正式发布了欧盟医疗器械法规(MDR)。2017年5月26日,MDR正式生效。 医疗器械指令MDD(93/42/EEC)和有源植入类医疗器械指令AIMDD(90/385/EEC)被医...
康复医疗器械,包括:电动轮椅、手动轮椅、助行器、病床,医用车,检查床,医用椅,医用凳,医用屏风,输液架,骨科牵引床,电动儿童床等等出口需要办理哪些认证呢?康复器材出口欧美需要CE认证、FDA认证医疗产品出口到欧盟地区,都必须要加贴CE标识,加贴CE标识的前提是企业必须有CE资质,即通过了CE符合性认证。“CE”标志是一...

前言医疗器械注册作为医疗器械监管工作中的一部分,越来越受到关注,注册申报工作也相对变得复杂。对于这个医疗器械注册的当中的一些流程和法规要求究竟是怎样,下面我们就来与大家来进行简单地介绍。1、法规文件中国医疗器械注册相关的法规包括:1)《医疗器械监督管理条例》(国务院令第650号)http://samr.cfda.gov...

医疗器械欧盟自由销售证书类别: 自由销售证明从颁发机构来看可以分为三类: 1.企业有中国的注册证生产许可证,可以申请中国药监局出的医疗器械产品出口销售证明; 2.出口产品和行业的国家主管当局出具,例如卫生部、药监局、商检局等; 3.国外主管当局出具给当地的授权代表,如英国的DH,或者是爱尔兰的IRSH。 欧盟国家出具...
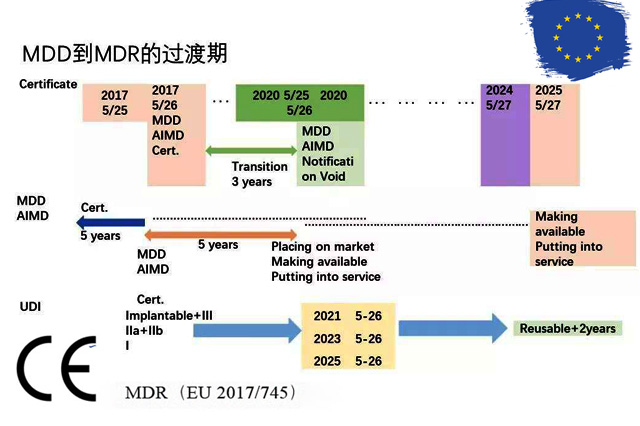
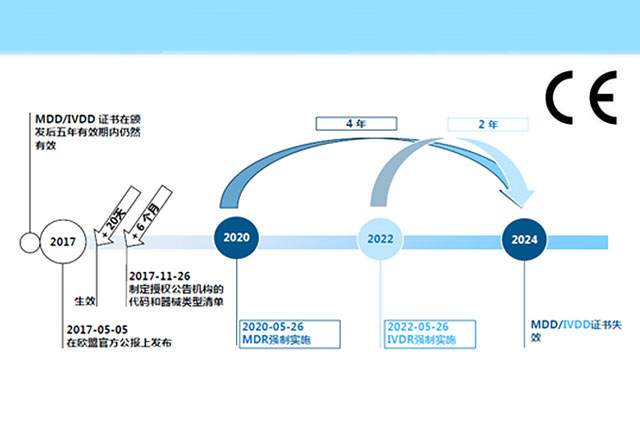
2017年欧盟官方期刊正式发布了欧盟医疗器械法规(Regulation (EU) 2017 / 745,简称“MDR”)。 MDR于2017年5月26日正式生效,在经过3年的过渡期后,将于2020年5月26日正式取代原有的MDD医疗器械(93 / 42 / EEC)和AIMDD有源植入式医疗器械(90 / 385 / ...

2017年5月5日,欧盟官方期刊(OfficialJournal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗...

2019年4月30日,东莞**医用包装科技有限公司零483通过FDA验厂审核,这是我司咨询团队对FDA验厂审核有着非常丰富的经验,对FDA审核官的审核方式、检查重点、思维习惯都很熟悉,全程英文陪审,无需企业提供翻译。 FDA验厂之所以让很多制造商紧张,是因为稍有不慎其结果的严重性可能会迅速放大,最终让制造商失去整个美国...


时间过得非常快,FDASUNGO曾经撰文提醒广大医疗器械厂商是时候该考虑MDR了,一年过去了,再过15个月,MDR就强制执行了( MDR强制执行的时间是2020年的5月26日)。在这个时间点就不应该仅仅是粗略地考虑了,而应该直接考虑那些关键的问题。FDASUNGO结合自己的经验总结了11个关键问题,以下是详细内容。 ...

欧盟自由销售证书也叫出口销售证明书 英文名称为:Free Sales Certificate、Certificate of Free Sale或者Certificate ForExportation of Medical Products;简称:FSC 或 CFS。 自由销售证书源于欧洲, 起初,欧洲经济区协定(E...