多个省级药品监管部门迅速启动医疗器械应急审批程序,按照“统一指挥、早期介入、随到随审、科学审批”的原则和确保产品安全、有效、质量可控的要求,对疫情防控所急需的医疗器械开展应急审批。
多个省级药监局已按照医疗器械应急审批程序批准医疗器械注册申请72个,包括医用防护口罩2个、医用外科口罩14个、一次性使用医用口罩17个、医用一次性防护服9个、一次性使用手术衣10个、可重复使用手术衣2个以及一次性使用医用帽2个,一次性使用手术帽、医用隔离病床、隔离舱、一次性使用手术巾包、一次性使用无菌手术单、一次性医用检查手套、一次性医用外科手套、无创呼吸机、鼻塞导管、加热呼吸管路、红外体温计、高流量呼吸湿化治疗仪、数字化移动式X射线机、一次性使用介入手术包、一次性使用气管插管包、一次性使用吸痰包各1个。
根据国家药监局外网数据统计,截至目前,全国共有批准注册证医用防护口罩65个,医用外科口罩164个,一次性使用医用口罩等334个,医用一次性防护服51个。在保证产品安全有效的前提下,全力保障疫情防控需要。
和新冠肺炎疫情战斗,必须争分夺秒!从市药监局获悉,该局依照法律法规和有关规定,在抗疫特殊时期实施医疗器械应急审批程序。此举只为力促医疗器械企业快速投产,保障我市疫情防控医疗物资供应。

据市药监局相关负责人介绍,该程序按照全盘摸底、现场核查、专家评估、应急审批、驻厂监督、协助检验、保证质量的思路,对申报生产应急医疗器械的企业加快审评审批速度,并帮助自身暂时无法进行全项目检验的企业开展24小时检验、减免相关委托检验费等贴心服务,全力帮促企业快速投产。
说到医用口罩,首先我们要搞清楚医用口罩的分类,才能知道我们需要生产哪一类的口罩。
从医疗器械分类目录上我们可以查到口罩的类别如下:
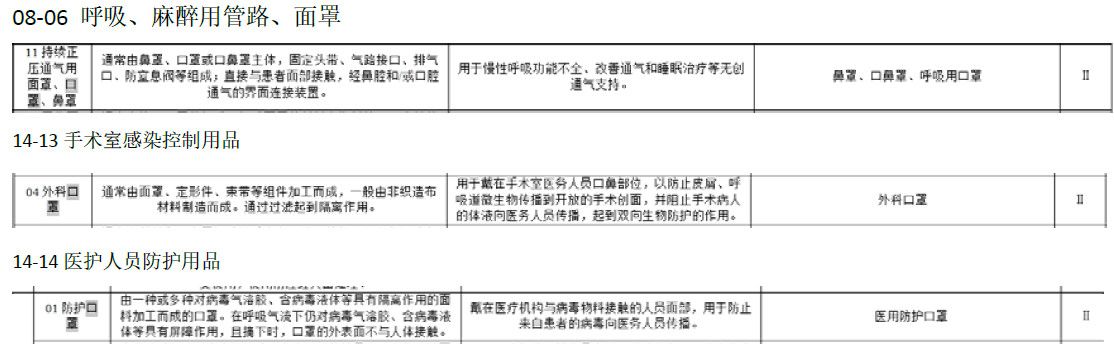
不论你想生产哪一类都是按照II类医疗器械管理,也就是说要在省药监局获取注册证和生产许可后方可生产。想要取得注册证,就要进行注册检验,就必须了解医用口罩的相关标准及注册要求:
YY0469-2011 医用外科口罩
YY/T 0969—2013一次性使用医用口罩
GB 19083—2010医用防护口罩技术要求
YY/T 0866—2011医用防护口罩总泄漏率测试方法
YY/T 1497—2016医用防护口罩材料病毒过滤效率评价测试方法 Phi-X174噬菌体测试方法
《医用口罩产品注册技术审查指导原则》
所以这将是一个漫长的过程。但根据不同的情况企业可以考虑如下途径:
1. 应急备案
在这个特殊时期,不少地方为帮助度过难关,开了“绿色通道”,例如江苏省就率先开启了应急医疗器械产品备案的程序,这对于有生产条件的企业来说无疑是个好消息,虽迅速搭建起一套质量管理体系随不是易事,但绝对可期。
2. 出口转内销
对于生产国外标准口罩的企业,有资质生产国内标准口罩的,各地药监局已给相关企业转成内部市场的渠道,来缓解资源不足的压力。
有条件的企业赶紧的,不要想了,就是干,为疫情贡献出自己的一份力量。
我们的服务:
1)协助医疗器械生产企业获得生产许可证;
2)协助医疗器械产品获得注册证。
医疗器械产品根据产品的用途可分为I类,II类,III类:
II类医疗器械产品注册证申请流程:
1)先确认产品的分类;
2)资质文件准备及填写申请表;
3)注册检测(包括:注册检测标准的判定、联络相关实验室,样品准备要求、样品根据要求准备及送检、自测报告的编制,检查);同时编写的相关文件资料(包括:产品综述材料、产品技术要求及产品标准、产品风险分析报告、说明书和标签的设计,修订、符合性声明、临床评价资料编写等先关的技术资料);
4)GMP体系的建立;
5)文件做好,检测报告下来,先网上申报及递交;
6)药监局现场考核;
7)不符合项的整改;
8)整改资料递交;
9)资料补发,后续跟踪,直到获取证书;

- 医疗器械
- 暂无标签




