
从事认证行业到现在,碰到过各种各样的认证,验厂,检测。其中验厂中的FDA验厂,是一个难点。下面来解释一下…… FDA验厂其实是一种俗称,而且是一个比较大的命题。因为就我们目前接触到的“验厂”,就有医疗器械的FDA验厂,也就是QSR820验厂,食品FDA验厂(依据美国 GMP110法规 21CFR Part110),OT...


欧盟自由销售证书也叫出口销售证明书 英文名称为:Free Sales Certificate、Certificate of Free Sale或者Certificate ForExportation of Medical Products;简称:FSC 或 CFS。 自由销售证书源于欧洲, 起初,欧洲经济区协定(E...

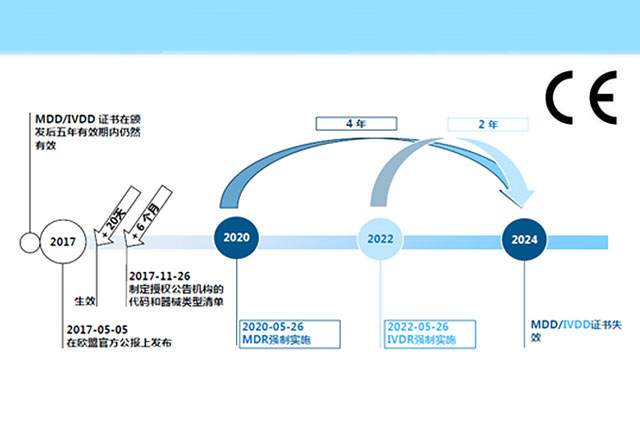
一、MDR简介2017年5月5日,欧盟官方公报正式颁布了“欧盟医疗器械法规”(REGULATION(EU)2017/745,简称“MDR”)。 MDR将取代指令90/385/EEC(有源植入式医疗器械指令)和93/42/EEC(医疗器械指令)。根据MDR第123条的要求,MDR于2017年5月26日生效,并于2020年...

申请FDA注册时不进行工厂检查,但是注册完成后每年FDA会在注册数据库里抽取部分企业进行飞行检查,在被FDA抽到后企业美国代理人US-Agent会接到FDA的通知,通知会包含检查的时间,目的,联系等信息。 企业生产的产品不同,那么被FDA抽查到验厂的企业,需要按照美国FDA法规也不一样 医疗器械FDA验...

医疗用品才可以办理欧盟自由销售证书的,欧盟国家有CE证书,ISO 13485证书就可以了,中东,南美 尤其是:沙特、阿根廷、埃及 这些国家会要这种欧盟自由销售证书的,客户销售企业的产品的时候,当地政府要求必须注册成功才可以销售产品,那么注册的时候是需要这些文件的,MHRA颁发的自由销售证书,能证明企业生产的产品满足欧盟...

什么是欧盟授权代表? 欧盟授权代表(European Authorised Representative 或European Authorized Representative)是指由位于欧洲经济区EEA(包括EU与EFTA)境外的制造商明确指定的一个自然人或法人。该自然人或法人可代表EEA境外的制造商履行欧盟相关的指...

越来越多的中国医疗器械企业把产品出口到全球各地,很多进口国强制要求生产商提供 “自由销售证书(FSC)” 他们并不认可中国药监局出具的相关证书,只认可欧盟国家官方机构出具的 “自由销售证书(FSC)”。1. 什么是自由销售证书?自由销售证书Free SalesCertificates,简称FSC。通常用于医疗产品的出口...

“如果科技是一粒毒品 ——确实感觉像毒品 ——那么它的副作用是到底什么呢?” ISO 27001旨在为信息保护提供统一和集中控制的管理体系。此外,通过有效监控IT安全风险,可降低各类业务流程所面临的威胁。 《黑镜》"黑函之舞"(Shut Up and Dance)描述一名...
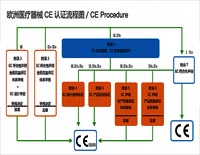
医疗器械CE标志 CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有C...

背景知识 为了更好地保护欧盟的消费者和环境,为了实现产品的可追溯性 (Traceability),欧盟的法律要求,制造商投放到欧盟市场的加贴了CE标志的产品必须标有制造商的名称和联络地址;如果制造商来自欧洲经济区EEA(包括EU与EFTA)以外的国家,其产品必须同时标有制造商和欧盟授权代表的名称和联络地址。 欧盟委...

婴儿纸尿裤、成人纸尿裤、卫生巾、拉拉裤、护理垫、婴儿尿裤、成人尿裤、月经杯、防溢乳垫、汗垫、湿巾等卫生用品,目前的出口量是非常大的,那么在出口贸易中,需要进行相关认证。出口欧盟时,则需要欧盟CE认证。那么,什么是CE认证? “CE”认证标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。CE认证是产品进入欧盟...

对于珠三角地区,即广州、深圳、佛山、东莞、惠州、中山、珠海、江门、肇庆,加上新规划扩容汕尾(深汕特别合作区)、清远、云浮、河源、韶关,许多企业进行生产销售。平日里,总是有人会问,什么是自由销售证,埃及、阿根廷、哥伦比亚、越南、沙特等客户口中提到的欧盟自由销售证是什么,怎么办,流程复杂吗,需要提供什么材料,有效期多长,是...
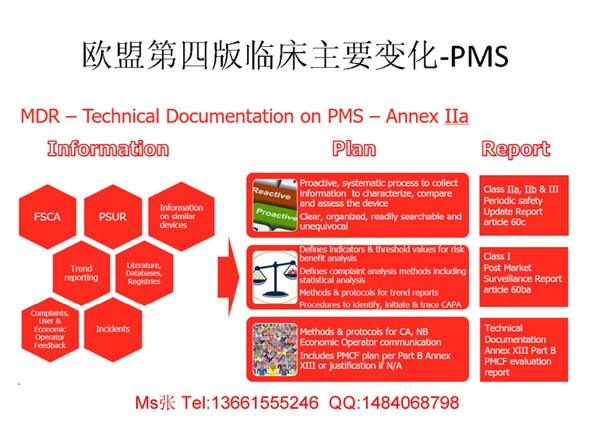
TUV年审时提出CE技术文件中第四版临床评价报告不符合要求CE第四版临床评价,随着MEDDEV 2.7.1第四版的出台且没有新旧版本的过渡期,符合制造商大利益的做法便是从现在开始与公告机构讨论如何开始实施这些新要求并从现在开始执行差距评估和资源需求评估。CE第四版临床评价,差距评估已迫在眉睫,因为制造商需要尽快为额外的...