2016年7月,第四版医疗器械临床评价的指导原则(MEDDEV 2.7/1 Rev. 4)在欧盟委员会(European Commission)网站上正式发布。 要点一、MEDDEV 2.7/1 Rev. 4 主要变化与说明 1. 澄清:临床评价报告(CER)的更新频率 条款6.2.3要求,对于高风险或不成熟的产品,C...
引言 2017年5月,欧盟正式发布了新的医疗器械法规MDR,该法规将取代现行的MDD医疗器械指令,于2020年5月4日正式强制执行。 同时,欧盟近期也加强了临床评价和上市后监督的要求,2016年7月,第四版医疗器械临床评价的指导原则(MEDDEV 2.7/1 Rev. 4)在欧盟委员会(European Commiss...
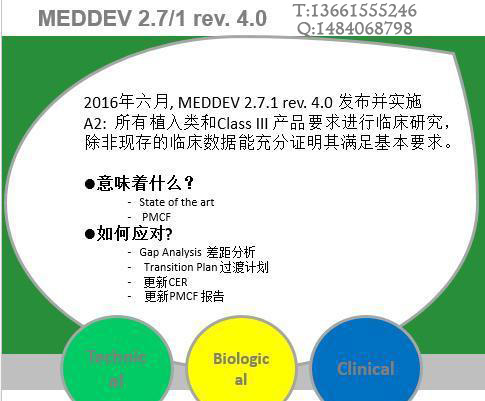
致各医疗医疗制造商: 欧盟医疗器械临床评价指南于进行了第四次修订, 目前大多数的公告机构已经不再接受基于第三版指导原则的临床评价报告;之前按照第三版完成临床评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价。 MEDDEV 2.7.1第四版的大变化之一,就是证明“实质等同”的难度要比之前大很多。关...

欧盟授权代表职责及其法规介绍 1. 授权代表应保存以下资料 i)符合声明, ii)标签、包装和使用说明的复印件(使用器械上市所在国要求的所有语言), iii)公告机关证明(相关的), iv)上市后监督过程和数据,警戒报告和投诉,过程和数据, v)由成员国开展的市场监督调查的相关技术文件, vi)相关临床数据/通告, ...
关于申请办理自由销售证书(Free Sales Certificate) 1. Background背景 Certificates of Free Sale are documentsused inthe registration or renewal of the registration, of medical...

医疗器械CE标志 CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有C...

• 什么是临床评估报告? • 谁需要提交临床评估报告? • MEDDEV 2.7.1(第4版)是如何定义临床数据的? 临床评估报告(CER) 制造商如果打算在欧洲销售医疗设备,必须提供一个符合MEDDEV 2.7.1(第4版)和MDD或MDR 2017/745的临床评估报告(Clinical Evaluation ...
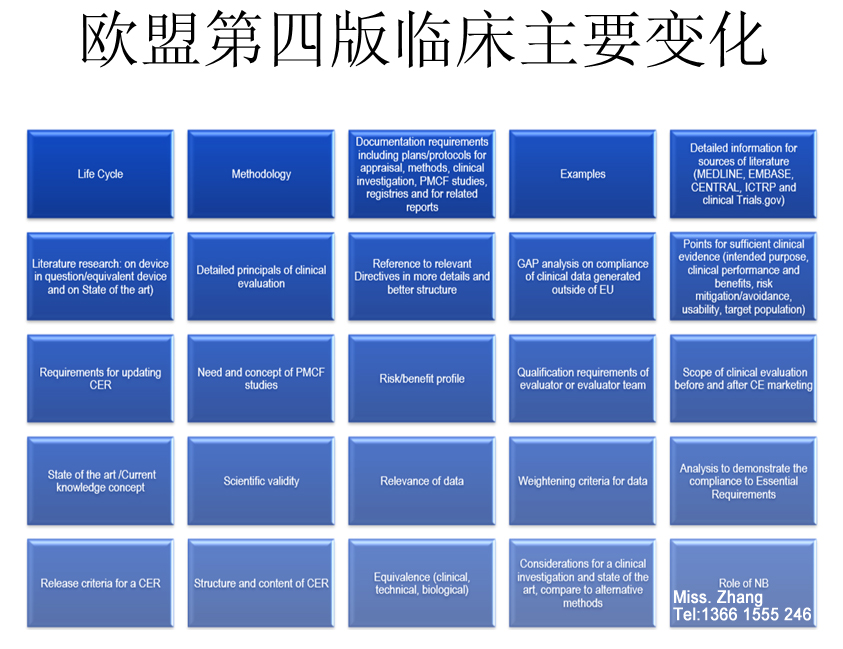
CE第四版临床评价报告MEDDEV 2.7/1 Rev. 4编写,你想知道的都在这了! 欧盟医疗器械临床评价指南于进行了第四次修订, 目前大多数的公告机构已经不再接受基于第三版指导原则的临床评价报告;之前按照第三版完成临床评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价。 MEDDEV 2.7.1...

关于申请办理自由销售证书 Free Sales Certificate 前言 我司至今为客户申请了数千份自由销售证书,其签发机构包括了国内行业协会、国内主管机构和欧盟主管机构,其中欧盟主管机构(英国和荷兰)签发的占到90%以上。 PART 1 自由销售证书的定义 自由销售证明,又称为出口销售证明,英文名称为Free...

近两年,欧盟加强了临床评价和上市后监督的要求。2016年7月,医疗器械临床评估的全新指导文件MEDDEV 2.7/1第4版在欧盟委员会网站上正式发布。该指南明确了现有的一些要求,对于制造商如何进行一个健全、系统的临床评价,以及如何证明数据和结论的科学有效性有了更明确的指导。这也给制造商带来了新的挑战。 该指南涉及9...