大多数国家都対医疗器械制定了相应的法规,以保枦公民的安全。不同国家对进入本国市场的医疗器械,要求各不相同。 FDA510(k)就是由美国食品和葯物管理局( 简称FDA》制定的美国市场标准。随着我国医疗器械行並的发展和加入世界贸易组织,美国器械市场的大门己向我国厂商敞开。据海美统计, 2002年我国对美国出口...

一、什么是UDI? 唯一器械标识(Unique Device Identification,缩写UDI)是美国FDA建立的”特殊医疗器械的识别系统”,是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。主要是一个由数字或字母组成的编码。由器械识别码(DI)和生产识别码(PI)组成。器械标识D...



FDA注册_FDA认证_FDA注册代理_FDA认证代理_FDA办理_上海FDASUNGO机构 一. FDA简介美国食品和药物管理局(Food and Drug Administration)简称FDA,FDA 是美国政府在健康与人类服务部 (DHHS) 和公共卫生部 (PHS) 中设立的执行机构之一。作为一家科学管理机...
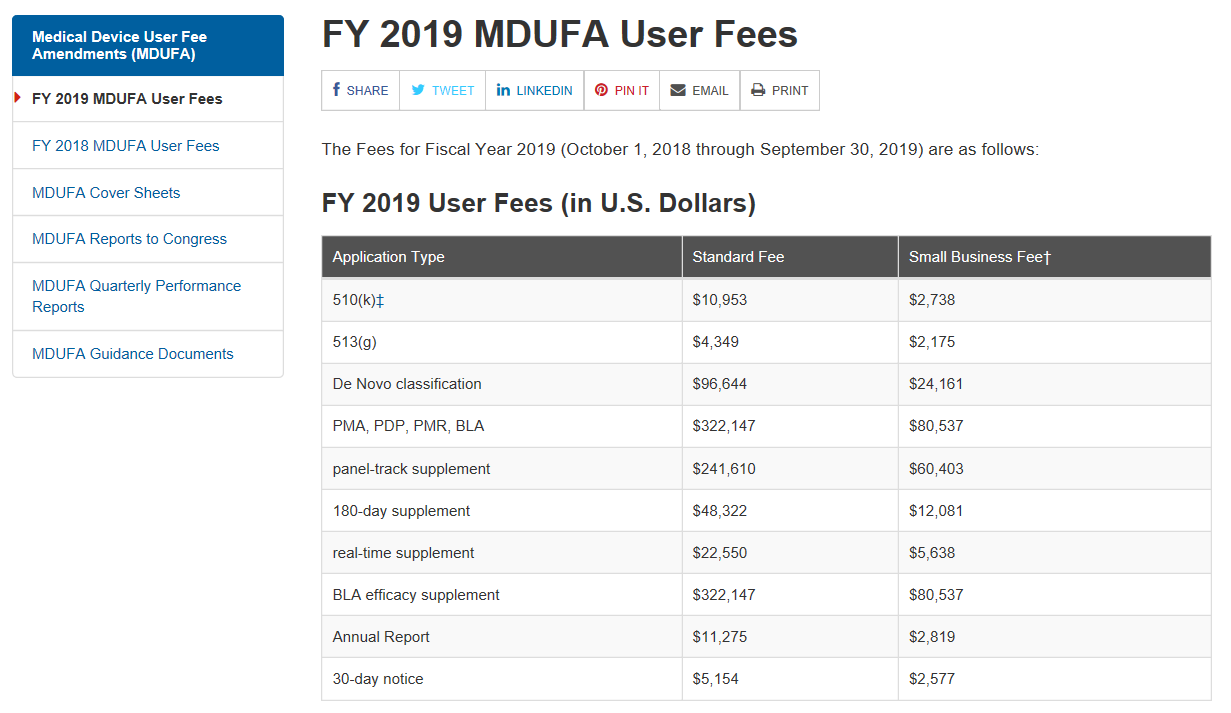
重点概要: 1)美国食品药品监督管理局(FDA)2019财政年医疗器械用户费用将增加约4%。 2)修订后的用户费用从2018年10月1日起生效。 3)与去年相比,最新的FDA医疗器械企业年度认证费增长幅度要小得多。 正文 美国FDA的医医疗器械注册用户费用包括510(k)和上市前批准(PMA)申请将在2019财年以比...

医疗器械FDA认证FDA对医疗器械的管理通过器械与放射健康中心(CDRH)进行的,中心监督医疗器械的生产、包装、经销商遵守法律下进行经营活动。 医疗器械范围很广,小到医用手套,大至心脏起博器,均在FDA监督之下,根据医疗用途和对人体可能的伤害,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,越高类别监督越多。如果产品是市场上不曾存在...

近几年,在美国以外的国际市场,中国制造商的被抽样量一直稳居全球首位。目前中国在FDA的注册制造商约为4500家左右,每年抽查的概率在2-3%。通常FDA工厂审查会由1名审查官进行为期4天的现场审查。制造商无需支付任何审查费用。 FDA验厂咨询步骤: 首先做好提前准备检查接待,建立一个检查应对管理小组,内部审计项目,...
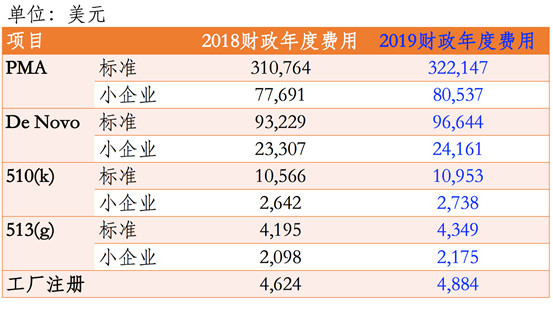
昨天(2018年7月30日)美国食品药品监督管理局(FDA)发布了联邦公报(83 FR 36598)公布了2019财政年度(2018年10月1日至2019年9月30日)医疗器械使用者费的费率。 根据医疗器械使用者费修正案IV的规定,2019财政年度FDA收取费用的总额为$190,654,875,考虑到通货...

我司应邀参与联影第二届医疗器械法规与标准高峰论坛 近期应上海联影医疗科技有限公司质量管理部的邀请,我公司技术总监Raymond Luo先生在联影第二届医疗器械与法规高峰论坛上分享了美国FDA验厂法规和应审经验。 论坛主题演讲时,我们从FDA官方发布的大数据总览FDA对全球及中国医疗器械企业进行监管的历史数据...

关于美国FDA验厂几种可能结果 前言 近年来我司为国内众多制造商提供了FDA验厂的辅导和翻译陪审服务。这其中包括了FDA提前五天通知验厂的时间极端紧迫的案例,也包括了为连续两次验厂失败的制造商解除警告信并移除进口禁令的复杂度极高的案例。 PART 1 FDA工厂审查的概况 FDA每年会对全球的医疗器械制...